Ausflüge in chemisch-technische Werkstätten
Ausflüge in chemisch-technische Werkstätten.
Giebt es wohl etwas Interessanteres und zugleich Erhebenderes, als der Natur Geheimnisse zu belauschen, zu sehen wie oft durch unscheinbare Ursachen dennoch so große Wirkungen hervorgebracht werden, und wie doch alle diese Wirkungen durch ewig unabänderliche Gesetze nothwendig bedingt sind? Die Naturwissenschaften nehmen immer mehr und mehr den Rang ein, der ihnen als Förderer der Wahrheit, und in Folge dessen als Förderern des geistigen und leiblichen Wohles der Menschheit von Rechts wegen zukommt, und Niemand wird ferner auf Bildung Anspruch machen dürfen, dem nicht mindestens die Pforten der Wissenschaft eröffnet sind. Nur Zeloten und sonstige Freunde allgemeiner Unwissenheit können diesen Gang der Dinge beklagen und anfeinden, aber alles Gegenarbeiten wird nutzlos sein und der Wahrheit nur die Bahn ebnen helfen. Vor Allem erfreulich ist es zu sehen, wie die einzelnen Zweige der Naturwissenschaften immer mehr und mehr praktisch in das Leben eingreifen lernen, wie neugemachte Entdeckungen nicht mehr im Wuste der Stubengelehrsamkeit vorkommen, sondern von speculativer Thätigkeit erfaßt, schnell lebenskräftig werden und so zur Hebung von Kunst und Industrie das Ihrige beitragen. Früher war es wohl eine gewöhnliche Erscheinung, daß die Praxis längst übte, wovon die Wissenschaft eine Erklärung zu geben nicht vermochte: man bereitete lange vorher Essig, ehe man wußte, daß der Sauerstoff der atmosphärischen Luft es sei, welcher die geistigen Flüssigkeiten sauer macht; in Sidon und Alexandrien bestanden Glashütten schon zu Plinius und Strabo’s Zeiten, aber erst die neuere Chemie lehrte, daß es die sauren Eigenschaften der Kieselerde seien, welche die Glasbildung bedingen.
Anders heut zu Tage: kaum ist eine neue Eigenschaft eines Körpers bekannt, so ist man bemüht, sie nutzbar zu machen, und selten bleibt die Mühe unbelohnt. Der näheren Kenntniß von den Eigenschaften des Wasserdampfes folgte seine Benutzung als bewegende Kraft; dem Nachweise, daß Stärkemehl sich durch Einwirkung von Wärme und Salpetersäure in eine gummiartige Substanz verwandeln lasse, folgte die fabrikmäßige Darstellung des Dextrins, welche mit Ersparung vieler Tausende, die für arabisches Gummi in das Ausland gingen, einen in gleicher Weise zu verwendenden Stoff aus einheimischen Produkten liefert. Tausend Beispiele dieser Art ließen sich noch aufführen, und wir mögen unsere Blicke hinwenden, wohin wir wollen, in die Werkstube des bürgerlichen Handwerkes oder auf den Acker des Landmannes, in die großen Etablissements der Fabrikstädte oder in die Tiefe zu den Revieren des Bergmannes, überall werden wir derselben Erscheinung begegnen: dem wohlthätigen Einfluß wissenschaftlicher Theorie auf die werkthätige Praxis. Nirgends aber tritt sie uns überzeugender und bekehrender entgegen als in jenen Werkstätten der technischen Chemie, die wir im Allgemeinen mit den Namen „chemischer Fabriken“ bezeichnen. Begleite mich, verehrter Leser, in einige derselben, und Du sollst die Ueberzeugung mit Dir fortnehmen, daß in der Natur Nichts unbedeutend ist, daß der unscheinbarste Stoff nur ein notwendiges Glied des großen Ganzen und einer Verklärung fähig ist, die stets fördernd auf das Ganze zurückwirkt.
Wir stehen vor einer Reihe Gebäude mit einigen hohen, dampfenden Schornsteinen, denen sich rundum verschiedene kleinere beigesellt finden, diese wie jene bemüht, den früher hellen Anstrich der Häuser möglichst balb verschwinden zu machen. Treten wir ein und betrachten zuvörderst die Rohstoffe, die hier verarbeitet werden, von denen wir in den Vorrathshäusern große Mengen finden: da begegnet uns zuerst ein alter Bekannter aus dem täglichen Leben, das Kochsalz oder wie die Chemiker es nennen, das Chlornatrium, weil Chlor und Natrium die beiden Elemente sind, welche es zu gleichen Atomen bilden; dort sehen wir einen Berg von Schwefel, ein Artikel, durch dessen Produktion das Königreich Neapel sich die ganze industrielle Welt zinspflichtig erhält, und dessen erschwerte oder verbotene Ausfuhr mehr als einmal [679] schon Englands Flotte in Bewegung setzte; weniger stürmisch, aber doch nachdrücklicher verfuhr damals die Wissenschaft: sie suchte sich andere Quellen des Schwefels zu eröffnen, und sie fand sie bald in den reichen Schwefelkieslagern Irlands, Englands und des Continentes. Die Folge war eine Concurrenz, die auch nach Ausgleichung jener Zwistigkeiten dauernd den Preis des sicilianischen Schwefels erniedrigte.
Weiter finden wir Tonnen mit Chilisalpeter, jenes schon so geschätzten Düngemittels, dessen Einfuhr von Jahr zu Jahr in größerem Maßstabe stattfindet. Dieser Chilisalpeter ist ein unreines salpetersaures Natron, welches sich in dem peruanischen Distrikte Atacama ausgewittert an der Bodenoberfläche findet und dort weite Landstriche überdeckt. Endlich sehen wir noch einen Haufen Kalksteine, Brennmaterial verschiedener Art, und erwähnen schließlich noch des fließenden Wassers, dessen Vertheilung durch Röhrenleitung nach allen Räumen der Fabrik geschieht, und der atmosphärischen Luft, die bekanntlich überall gratis zu haben ist, als Rohstoffe, denn beide sind nothwendige Dinge als Vermittler, wie als wirkliche Theilnehmer chemischer Verbindungen. Fragen wir nun nach den Fabrikaten des Etablissements, so nennt man uns als hauptsächlichstes die Schwefelsäure, die Salzsäure, die Salpetersäure oder das Scheidewasser, die Soda, das Glaubersalz und den Chlorkalk. Wie mannigfaltig müssen die Processe sein, welche aus so einfachen Dingen so Verschiedenartiges erzeugen, und wie glänzend hat des Menschen Geist durch genaue Beobachtung der Naturgesetze hier seine Aufgabe gelöst!
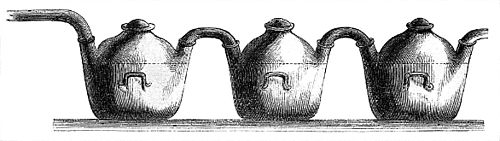
Wir wenden nun unsere Schritte zu den der Schwefelsäurefabrikation gewidmeten Räumlichkeiten, und finden hier zunächst einen zur Verbrennung des Schwefels dienenden Ofen, dessen Doppelgehäuse nicht allein zur Regulirung der Hitze, sondern auch zur Speisung der in der Nähe befindlichen Bleikammern mit atmosphärischer Luft dient. Der Schwefel nimmt beim Verbrennen zwei Atome Sauerstoff auf und bildet damit schwefelige Säure, jene bekannten weißen Dämpfe, die wir beim Abbrennen eines Schwefelhölzchens beobachten, und deren stechender Geruch eben so bekannt als den Athmungswerkzeugen lästig ist. Diese Dämpfe der schwefeligen Säure treten nun durch ein Rohr in die Bleikammern, große Gefäße aus Walzblei, oft geräumig genug, um ein mäßiges zweistöckiges Haus in eins derselben setzen zu können, von denen gewöhnlich vier bis fünf hinter- oder nebeneinander angebracht sind; hier begegnen dieselben Salpetersäuredämpfen, die durch die Hitze der Schwefelverbrennungsofens aus salpetersaurem Natron mittelst Zerlegung durch Schwefelsäure ausgeschieden werden; sie begegnen Wasserdampf, welcher aus einem Dampfkessel hierher geleitet wird, und endlich der durch den Mantel des Schwefelofens eingetretenen atmosphärischen Luft. Auf dem Wege nun, den die Dämpfe gemeinschaftlich zu machen haben, und der durch gezwungenes Auf- und Absteigen möglichst verlängert wird, mischen sich dieselben, und die schwefelige Säure wird zu Schwefelsäure (auf einen Centner Schwefel drei Centner Sauerstoff), indem sie den Dämpfen der Salpetersäure (aus zwei Atomen Stickstoff und fünf Atomen Sauerstoff bestehend) den ihr noch fehlenden Sauerstoff entzieht und dieselbe zu Stickoxydgas reducirt; das Letztere hingegen sucht diesen Verlust wenigstens theilweise wieder zu ersetzen durch Aufnahme von Sauerstoff aus der vorhandenen atmosphärischen Luft, aber nur um denselben sofort an neue Portionen schwefeliger Säure abzugeben und diese wiederum in Schwefelsäure zu verwandeln; und so wiederholt sich dieses Spiel, bis die letzten Antheile schwefeliger Säurezu Schwefelsäure geworden sind.
Der Wasserdampf spielt nun hierbei eine doppelte Rolle: einerseits ist seine bloße Gegenwart zur Vermittelung der Aufnahme des Sauerstoffs durch das Stickoxydgas nothwendig, andererseits verdichtet er sich mit den fertigen Schwefelsäuredämpfen zu wässeriger Schwefelsäure, die nun an dem Boden der Bleikammern zusammenfließt und von dort abgelassen werden kann. Diese wässerige Schwefelsäure ist aber weit entfernt die für technische Zwecke erforderliche Stärke zu besitzen, sie ist im Gegentheil mit einer großen Menge überflüssigen Wassers verdünnt, und muß von demselben noch befreit werden. Zu diesem Zwecke kommt die Säure nun zunächst in die Bleipfannen. Wir sehen in unserer Fabrik deren drei, und zwar etagenförmig auf eisernen Platten ruhend, unter denen die Feuerluft hinstreicht. Während der Siedepunkt des Wassers bekanntlich bei 100° C. liegt, wo nun auch die Verdampfung desselben beginnt, ist der Siedepunkt der Verdampfungspunkt der Schwefelsäure erst bei 326° C. erreicht. Man treibt daher die Verdampfung des Wassers in den Bleipfannen bis zu dem Punkte, wo die mit der fortschreitenden Concentration der Flüssigkeit sich steigernde Hitze einen Grad erreicht, bei welchem neben dem Wasser sich auch Schwefelsäure verflüchtigen würde, und wo außerdem die Bleipfannen durch die stärkere Säure angefressen werden würden. Durch eine sinnreiche Hebervorrichtung gelangt nun die Flüssigkeit in eine Destillirblase von Platin, wo sie sich durch ferneres Erhitzen bis aus 326° C. in saures Wasser, welches durch das Helmrohr abdestillirt und wieder in die Bleipfannen zurückgebracht wird, und in Schwefelsäurehydrat oder englische Schwefelsäure scheidet, welche Letztere in der Blase verbleibt und von dort durch abermalige Hebervorrichtung, die zugleich durch Abkühlung der heißen Säure dient, in große Glasballons gebracht wird und nun als fertiges Produkt in den Handel kommt.
Wie schon erwähnt, sind diese Destillirblasen von Platin, da Glas ein zu zerbrechliches Material ist, und kein anderes Metall, das noch teurere Gold ausgenommen, der starken Säure widerstehen würde. Man fertigt dieselben fast ausschließlich in Paris von 5 bis 20 Centner Inhalt; die Fugen werden mit Gold gelötet und der Preis eines solchen Apparates beträgt allein schon 10–15,000 Thaler!
Diese Schwefelsäure, nunmehr auf ein Atom reiner Säure genau ein Atom Wasser enthaltend, ohne welches die Säure gasförmig und daher nicht zu handhaben sein würde, ist eins der wichtigsten chemischen Produkte, ohne dessen Vorhandensein der ganze heutige Stand unserer Industrie unmöglich wäre. Sie ist das Mittel zur billigen Darstellung der Soda geworden, ohne welche wir wiederum weder so billige Seife, noch so schönes und billiges Glas haben würden; die Färberei und Kattundruckerei wären ohne Schwefelsäure um die Hälfte ihrer Farben ärmer; die Darstellung des Scheidewassers, der Salzsäure und des Bleichkalkes wäre wesentlich erschwert, und statt Stearinkerzen brennten wir nach wie vor rußende Talglichter. Darum ist aber auch der Verbrauch an Schwefelsäure ein ungeheurer, und eine einzige Fabrik zu St. Rollox bei Glasgow erzeugt allein jährlich 160,000 Centner Säure in 20 Bleikammern, von dessen jede, bei 70 Fuß Länge, 38,000 Kubikfuß hält!
Wir setzen nun unsere Wanderung fort und finden in einem benachbarten Gebäude verschiedene Flammenöfen, welche zur Darstellung des Glaubersalzes aus dem Kochsalze dienen.
Ein solcher Ofen theilt sich hinter der Feuerbrücke in zwei getrennte, mit Bleiplatten ausgefütterte Räume; in dem hinteren weniger heißen Theile geschieht die Zersetzung, welche aber erst in dem vorderen, dem Feuer mehr ausgesetzten Raume durch völliges Schmelzen der Salzmasse beendigt wird. Die Beschickung besteht in vier bis acht Centnern Kochsalz oder zerstoßenes Steinsalz, auf welche vermittelst eines besonders construirten Trichters die zur Zersetzung nöthige Quantität Schwefelsäure aufgegossen wird, wozu man der Ersparniß halber Schwefelsäure, wie sie aus den Bleikammern kommt, verwendet, da eine größere Concentration [680] nicht nothwendig ist. Unter der Einwirkung der Schwefelsäure zerfällt nun das Kochsalz in seine Bestandtheile: Natrium und Chlor. Das Natrium zersetzt wiederum einen Atom Wasser und bildet mit dem Sauerstoff des Letzteren Natrium-Oxyd oder Natron, welches mit der Schwefelsäure zu schwefelsaurem Natron oder dem sogenannten Glaubersalz zusammentritt. Das aus dem Kochsalz zugleich freigewordene Chlor aber vereinigt sich mit dem aus dem zersetzten Wasser ebenfalls freigewordenen Wasserstoff und bildet damit Salzsäure, welche in Gasform entweicht und in besonderen Kanälen ihrer ferneren Benutzung entgegengeführt wird. Früherhin als der Verbrauch an Salzsäure noch unbedeutend war, wurde dieselbe sehr oft eine große Last für die Fabrikanten, indem sie mit dem abziehenden Rauche die Esse passiren mußte, und sich bei ihrem Heraustreten aus derselben, von der atmosphärischen Feuchtigkeit verdichtet, zu Boden senkte, die Pflanzenwelt der Umgebung zerstörte und der ganzen Nachbarschaft beschwerlich fiel, wodurch sie zu einer Quelle von Klagen und Entschädigungsansprüchen wurde. Man versuchte die mannigfachsten Mittel zur Beseitigung des Uebelstandes, und erreichte endlich den Zweck wenigstens theilweise durch entsprechende Erhöhung der Schornsteine; so ragt aus der Fabrik von Muspratt, zwischen Liverpool und Manchester, ein kegelförmiger Kamin von 495 Fuß Höhe empor, der bei 301/2 Fuß unterem und 11 Fuß oberem Durchmesser über eine Million Ziegel enthält!
Eine andere Art von Flammenöfen, die wir neben jenen aufgestellt finden, dient nun dazu, das erhaltene schwefelsaure Natron oder Soda zu verwandeln. Diese Oefen sind größer, und ihr Schmelzraum zur Vermeidung aller Ecken, welche dem nothwendigen häufigen Durchdrücken der Masse hinderlich sein würden, oval. In diesen trägt man nun das zuvor gepulverte und mit etwas mehr als dem gleichen Gewicht Kalksteins und der reichlichen Hälfte Kohle gemischte Glaubersalz ein und läßt das Feuer wirken. Durch die Hitze wird das Gemenge breiartig und entwickelt bei vorrückender Schmelzung eine Menge Gasblasen, die ihm das Ansehen des Kochens und Aufwallens ertheilen, mit dessen Aufhören und dem nun eintretenden ruhigen Fluß der Masse die Zersetzung als beendigt angesehen werden kann.
Der Vorgang im Ofen war nun folgender Art: die Kohle verbrennt mit dem ganzen Sauerstoffgehalt des Glaubersalzes zu Kohlenoxyd, und hinterläßt jenes als Schwefelnatrium; mit diesem tauscht nun der kohlensaure Kalk seine Bestandtheile aus, und es entsteht daraus Schwefelcalcium und kohlensaures Natron. Die noch fließende Salzmasse kommt zur Abkühlung in blecherne Kästen und stellt sodann die rohe Soda dar, wie sie allerdings schon für für manche Gewerbe brauchbar ist. Diese rohe Soda, die das Ansehen einer grauen schlackigen Asche besitzt, enthält natürlich außer dem kohensauren Natron noch alles Schwefelcalcium, so wie eine gewisse Menge noch unzersetztes schwefel- und schwefeligsaures Natron, Kochsalz, kohlensauren Kalk und Kohlenstückchen, Verunreinigungen, die die nun folgenden Operationen zu entfernen den Zweck haben.
Treten wir jetzt heran zu den Auslaugebottichen, einer Reihe eiserner Kästen, die etagenförmig, d. h. jeder einige Zoll höher als der vorhergehende aufgestellt sind. Wir sehen sie Alle durch eine Doppelscheidewand in zwei Hälften geheilt, so jedoch, daß diese Hälften durch eine untere und obere Oeffnung in den Scheidewänden noch in Verbindung stehen. Das Ganze ist mit Wasser gefüllt, welches durch eingeleiteten heißen Wasserdampf beständig auf dem nöthigen Temperaturgrad erhalten wird. In jeder Hälfte finden wir zwei siebartig durchlöcherte Blechkasten mit grob gemahlener, roher Soda gefüllt, so eingehangen, daß sie eben unter die Oberfläche des Wassers tauchen. Dieses zieht nun alles Lösliche aus, und die hierdurch schwerer gewordene Flüssigkeit senkt sich zu Boden, um von da entweder in die andere Hälfte oder in den nächsttieferen Bottich abzufließen, während man die Siebkästen den umgekehrten Weg machen läßt, d. h. die frisch gefüllten zuerst in den untersten Bottich bringt und nach und nach weiter hinauf hängt, bis sie aus dem obersten Bottiche völlig erschöpft herausgenommen und vom unlöslichen Rückstande entleert werden.
Durch diese sinnreiche Einrichtung wird es möglich, daß das oben beständig zulaufende Wasser im unteren Bottiche zu siedewürdiger Sodalauge umgewandelt ist, die unverzüglich in die Siedepfannen abgelassen und zu dem Grade der Concentration gebracht wird, daß sich beim Erkalten das kohlensaure Natron in großen Krystallen ausscheidet, die unter dem Namen krystallirte Soda in den Handel gebracht werden. Wird diese krystallirte Soda in einem mäßig warmen Lokale auf Horden ausgebreitet, so verlieren die Krystalle ihr Krystallwasser und zerfallen zu einem weißen Pulver, welches den Namen trockene Soda oder Sodasalz führt.
Die Flüssigkeit, welche nach Abscheidung der Krystalle zurückbleibt, enthält neben etwas kohlensaurem Natron noch alle löslichen Bestandtheile der rohen Soda; man trocknet sie daher ein und setzt die erhaltene Salzmasse, mit Kohle und Kalk vermischt, wieder den Ofenbeschickungen hinzu. Die in den Siebkästen verbliebenen unlöslichen Rückstände werden getrocknet als ein vortreffliches Düngemittel für Klee und Hülsenfrüchte verkauft; neuerdings auch durch Brennen mit Thon zu Portland-Cement verarbeitet.
Es ist kaum ein halbes Jahrhundert verflossen, seit man diese Art der Sodabereitung kennen gelernt hat; früher zog man alle Soda aus der Asche der Seepflanzen, und noch gegen das Ende des letzten Jahrhunderts gingen dafür über 30 Millionen Franken jährlich allein aus Frankreich nach Spanien, dem Hauptsitze der Sodaerzeugung. Da kamen Frankreichs große Kriege und mit ihnen zunächst eine Isolirung vom Auslande, die den Gewerben die nothwendigsten Hülfsmittel entzog. Der einzig mögliche Ersatz der Soda, die Potasche, wurde von den Salpetersiedereien zur Pulverfabrikation ausschließlich in Anspruch genommen, und die Noth drängte von allen Seiten: da erließ im Jahre II. der Republik [681] der Wohlfahrtsausschuß eine Aufforderung an alle Bürger, binnen zwei Decaden mit Hintansetzung jedes Privatvortheils, Mittel und Wege zur Erzeugung von Soda ausfindig zu machen und die Vorschläge an eine dazu niedergesetzte Commission abzugeben. Dieses für die fernere Geschichte der Industrie so einflußreiche Aktenstück begann mit den Worten:
„In Erwägung der Pflichten der Republik, welche ihr gebieten, die Kraft der Freiheit mit ihrem ganzen Nachdrucke auf alle diejenigen Gegenstände hinzulenken, welche die Grundlage der unentbehrlichsten Gewerbszweige sind; Pflichten, die ihr ferner gebieten, die Fesseln der Handelsabhängigkeit abzustreifen und aus ihrem eigenen Schooß Alles, was die Natur darin niedergelegt hat, an’s Licht zu ziehen; eben so um die gehässigen Zwangsmittel der Despotie zu entkräften, als um die Gaben des Boden und der Gewerbthätigkeit in Anspruch zu nehmen; in Erwägung Dieses ist beschlossen und sind alle Bürger gehalten etc.“ –
Die Commission erkannte das Verfahren von Leblanc[WS 1] als das Zweckmäßigste, und in der That ist dasselbe bis heute kaum verbessert worden. Den großen Preis aber, den Napoleon für diese Entdeckung ausgesetzt hatte, erhielt Leblanc nicht; die Bourbonen erkannten bei ihrer Rückkehr die Schuld nicht an, sie ward vergessen und verjährte; statt dessen entstanden allerwärts Sodafabriken nach Leblanc’s Verfahren als Denkmäler seiner uneigennützigen Thätigkeit, und die Nachwelt wird ihn stets als großen Wohlthäter der Menschheit verehren.
Doch kehren wir zurück in unsere Fabrik!
Wir bemerkten bereits, wie aus dem Einsatze des ersten Ofens, bestehend aus Kochsalz und Schwefelsäure, Dämpfe von Salzsäure entwichen. Dieselben finden nun aber nicht so ohne Weiteres einen Ausweg; man zwingt sie vielmehr, eine Reihe mit Wasser gefüllter Gefäße aus Steinzeug zu passiren, wo der größte Theil derselben von diesem Wasser absorbirt wird und dann wenn dasselbe damit gesättigt ist, die rohe Salzsäure darstellt, die im Gewerbewesen so mannigfache Anwendung findet. Dennoch aber ist die Nachfrage selten so groß, um die bei ununterbrochenem Betriebe einer größeren Sodafabrik erzeugte Salzsäure als solche zu verwerthen, und man verwendet daher diesen Ueberschuß zur Darstellung des Chlor- oder Bleichkalkes. Die Salzsäure, eine Verbindung der Elemente Chlor und Wasserstoff, wird zu diesem Zwecke der Einwirkung des Braunsteins ausgesetzt, eines Ueberoxyds des Metalles Mangan, das sich in manchen Gebirgen, wie z. B. im Harz, im Vogelsgebirge in Hessen und an anderen Orten in großer Menge vorfindet. Die hier nun stattfindende Zersetzung ist der Art, daß der Sauerstoff des Braunsteins sich mit dem Wasserstoff der Salzsäure zu Wasser verbindet und das Mangan mit 1/3 des freigewordenen Chlors zu Manganchlorür zusammentritt, während die anderen 2/3 des Chlores frei werden und als Gas entweichen. Man leitet dasselbe nun in große, geschlossene Kammern von 30–40 Fuß Länge, in denen auf Horden trocken gelöschter Kalk in dünnen Schichten ausgebreitet ist, welcher das Chlor begierig aufsaugt und damit den Chlor- oder Bleichkalk darstellt. Dieser Chlorkalk ist das Mittel geworden, durch welches das Bleichen der leinenen und baumwollenen Stoffe in erstaunlich kurzer Zeit ermöglicht wird, ohne dieselben mehr anzugreifen als dies durch die früher allgemeine Rasenbleiche der Fall ist; so bleicht ein einziges Etablissement in der Nähe von Glasgow täglich 1400 Stück Baumwollenzeug Sommer und Winter hindurch.
Mit welcher Zeit- und Kostenersparniß würden unsere Hausfrauen ihrer Wäsche ein blendendes Weiß ertheilen, wollten sie den gleichen Weg einschlagen und der althergebrachten Rasenbleiche entsagen! Sie, meine Damen, wie Ihre Wäsche, könnten nur dabei gewinnen, wobei allerdings zu bemerken ist, daß diese Operation in größeren Etablissements unter Leitung einer kundigen Person geschehen müßte.
Wir kommen nun zu dem letzten Theile unserer Fabrik, zu dem der Scheidewasserbrennerei gewidmeten Räumen. Das Verfahren hierbei ist ein einfaches und leicht verständliches. Wir finden in sogenannten Galeerenöfen eine doppelte Reihe gläserner Retorten, die zur gleichmäßigeren Erhitzung jede in eine mit Sand ausgestreute, gußeiserne Schale (Capelle genannt) eingesetzt sind. In diese Retorten bringt man salpetersaures Natron mit der nöthigen Menge Schwefelsäure, welche Letztere beim Erhitzen die Salpetersäure verdrängt und diese in die gläsernen Vorlagen überdestilliren macht. Die Erfahrung hat hierbei gelehrt, daß diese Zersetzung nur dann vollständig vor sich geht, wenn auf ein Atom Natron zwei Atome Schwefelsäure vorhanden sind, so daß im Rückstande in der Retorte nicht einfach schwefelsaures, sondern doppeltschwefelsaures Natron bleibt, welches Salz leicht in Glaubersalz zu verwandeln und dann bei der Sodafabrikation wieder zu verwenden ist. Die abdestillirte Salpetersäure kommt nun in den Handel, wo man dem wirklichen Gehalt an Säure entsprechend einen Unterschied zwischen einfachem und doppeltem Scheidewasser macht; oder man reinigt sie durch nochmalige Destillation von etwaigen Beimischungen von etwas Schwefel- oder Salzsäure. Es dient die Salpetersäure verschiedenen Gewerbszwecken, wie zur Scheidung des Silbers und Goldes, zum Aetzen der Kupferstiche u. s. w.
Wir sind nun am Ende unserer Wanderung, und indem wir nochmals rückwärts schauen, sagen wir uns, daß diese Werkstätte der Chemie nur ein Bild der allwaltenden Natur ist: hier wie dort Zerstörung zu neuer Wiedergeburt! Nirgends ein Verlust, sondern für jedes Atom eine neue Benutzung.